文件來源:
新增檢驗審查作業程序(CPCML-QP-1901)
一、臨床單位新增檢驗需求應提出「
臨床需求/新增檢驗申請表(R-CPCML-Q-1901-01)」。
二、填妥上述表單交由醫學檢驗品質管理會執行秘書視項目特性,續與相關實驗室協商新增項目可行性。
三、新增: 實驗室自行研發檢驗技術(Laboratory Developed Tests, LDTs)類項目,請備妥LDTs計畫書方受理新增檢驗申請。
四、新增檢驗審查作業相關表單下載路徑:
知識館/SOP標準文件/ISO15189醫學實驗室認證/臨床醫學實驗及病理診斷中心/中心五階表單下載區
五、聯絡窗口:醫學檢驗暨輸血品質管理會執行秘書 呂昆穆品保副主任(分機:3381)、email:armshunter@vghtc.gov.tw
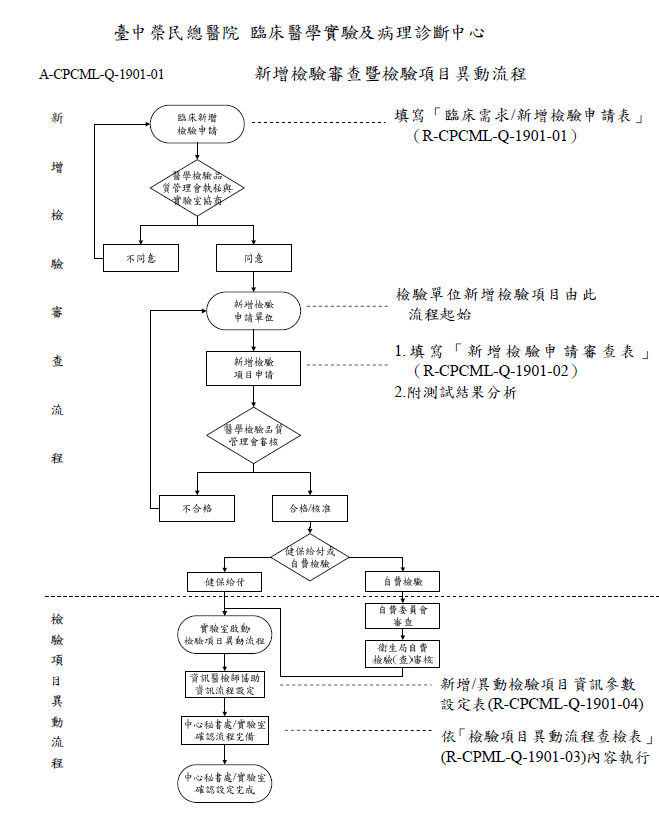
六、「新增檢驗審查暨檢驗項目異動流程」如下,請參閱。