×
認識中榮
我們的家長
沿革
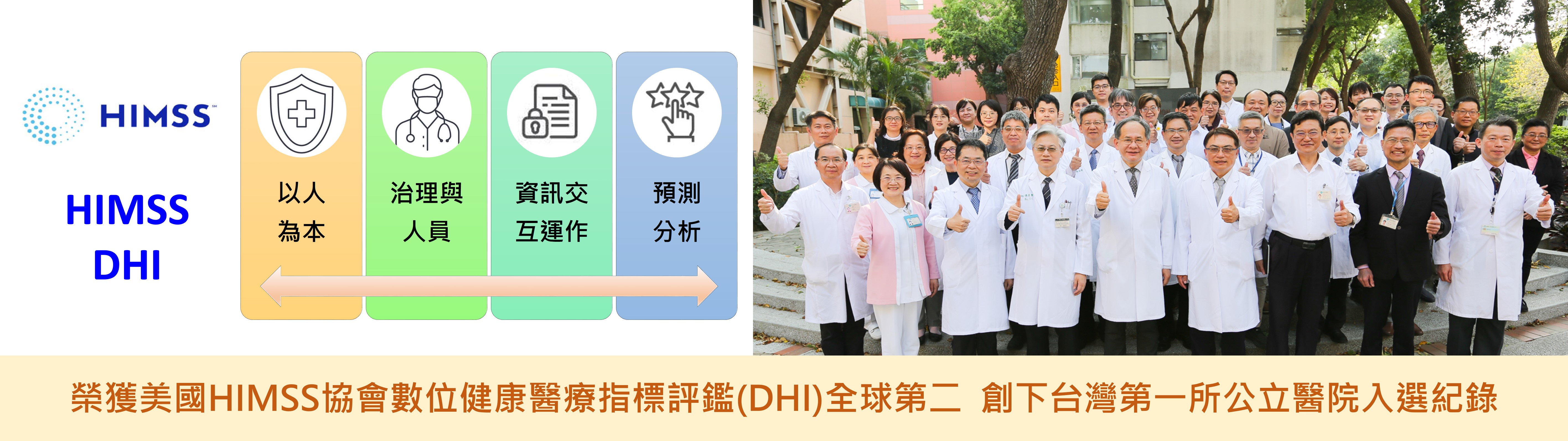
特色與貢獻
組織架構
組織規程與編制
副院長業務職掌
醫療部科
行政單位
教學部
醫學研究部
任務編組
管理委員會
各委員會、管理會及工作小組指導長官一覽表
醫療服務及研究統計.服務規模
願景.未來展望
肯定本院服務專區(感謝函)
我們的榮耀
2024年
2023年
2022年
2021年
2020年
2019年
2018年
2017年
2016年
2015年
2014年
2013年
2012年
2011年
2010年
數位院史館
醫學人文專區
志願服務工作
醫療團隊
皮膚科
內科部
外科部
婦女醫學部
兒童醫學中心
口腔醫學部
家庭醫學部
眼科部
護理部
藥學部
重症醫學部
神經醫學中心
泌尿醫學部
心臟血管中心
放射線部
病理檢驗部
急診部
骨科部
精神部
耳鼻喉頭頸部
麻醉部
放射腫瘤部
復健醫學部
核醫科
傳統醫學部
營養室
感染管制中心
品質管理中心
高齡醫學中心
腫瘤醫學中心
就醫指南
醫師專長介紹
交通指南
停車及繳費
停車位查詢
接駁車時間
樓層介紹
交通路線
院內地圖
環景導覽
門診服務導引
掛號預約服務
網路掛號
門診預約抽血
門診抽血進度
四癌篩檢服務
抽血服務時間
預約慢性病連續處方箋領藥
門診時刻表
門診公告
該看哪一科
轉診服務
轉診轉檢服務
檢驗報告天數查詢
服務電話
預約掛號專線
服務諮詢電話
單位服務專線
醫療服務專線
住院暨出院服務
全院病床動態表
住院服務導引
住院名單查詢(限院內)
出院準備服務網
病房介紹
住院飲食
急診服務導引
收費資訊
健康檢查服務
病人權利
常見問答集
便民服務
各項申辦說明及電話
住院整合照護服務
看診/領藥進度
探病陪病預約系統
停車位查詢
慢箋/抽血預約
衛教專區
衛教單張
影音衛教
藥物諮詢
門診抽血進度
手術/恢復室動態
線上申辦服務
申請受理流程
決定取件方式
選擇申辦項目
查詢申辦結果
自然人憑證說明
愛滋病匿名篩檢
熱門網頁排行
服務信箱
醫療諮詢信箱
首長信箱
廉政服務窗口
性騷擾事件服務窗口
身心障礙資訊
哺集乳室
分類檢索
訊息專區
最新消息
門診公告
政策宣導
記者會訊
徵才訊息
失物招領
門診衛教時間
中榮醫訊
多媒體專區
消保專區
性別平等專區
資訊公開
特色醫療
人工生殖中心
心理健康中心
達文西手術中心
分枝桿菌中心
巴金森症暨動作障礙中心
細胞治療與再生醫學中心
日照中心
功能性食道疾病中心
失智症中心
全院健康暨體重管理中心
戒菸治療管理中心
罕見疾病基因治療中心
罕見疾病暨血友病中心
兒童發展聯合評估中心
肺癌整合照護暨研究中心
消化系內視鏡診斷治療中心
脊柱裂與膀胱腸道功能障礙中心
脊椎疾病治療暨研究中心
骨髓移植中心
高壓氧治療中心
乾癬整合照護中心
健康管理中心
國際醫療中心
淋巴水腫醫療中心
產後護理之家
眼外傷中心
發炎性腸道疾病中心
間質性肺病整合照護中心
傷口造口整合照護中心
感染症基因體中心
腦中風中心
睡眠呼吸障礙照護中心
糖尿病中心
遠距照護中心
整合癌症資源中心
遺傳諮詢中心
職業傷病預防及重建中心
攝護腺中心
專業人士專區
品質指標資訊平台
轉診轉檢報告查詢
代檢報告查詢
AIR代檢報告查詢
外包人員專屬系統
品質管理中心
人體研究倫理審查委員會
人體生物資料庫
臨床試驗中心
臨床試驗計畫查詢
技術移轉中心
院內專區
員工報到及離職專區
員工消費合作社
員工入口網
人事服務網eCPA
中榮通報系統
中榮e學網
中榮圖書館
榮中幼兒園暨中榮托嬰中心
OMOP CDM臨床數據資料庫
 分享
English
網站導覽
分享
English
網站導覽